新闻网讯(通讯员赵珺)近日,Developmental Cell(《细胞·发育》)在线发表了武汉大学医学研究院/免疫与代谢前沿科学中心/中南医院生物样本库蒋卫教授课题组关于脂肪酸代谢调控内胚层分化的分子机制的最新研究成果。
论文题为“Fatty acid synthesis and oxidation regulate human endoderm differentiation by mediating SMAD3 nuclear localization via acetylation”。医学研究院博士研究生弋颖为论文的第一作者,蒋卫为论文的通讯作者。研究生兰贤春、李迎雷、闫晨超、吕静、张天喆等也作出了重要贡献。

目前对于早期胚胎发育和干细胞命运决定的研究主要关注于转录因子、信号通路和表观遗传,然而细胞代谢作为细胞命运转换过程中最早出现变化的生命活动之一,其对于早期胚层分化的影响仍知之甚少。研究表明,脂肪酸代谢(fatty acid metabolism)活性以及相关产物的丰度在胚胎干细胞自发分化的早期阶段就发生明显变化,但脂肪酸代谢是否以及如何在内胚层命运决定中发挥作用尚不清楚。
团队首先描述了在人内胚层分化过程中,脂肪酸氧化通路与脂肪酸合成通路的水平发生相反的变化,这一变化改变了细胞内乙酰辅酶A的丰度进一步通过蛋白质翻译后修饰的方式调控内胚层分化。团队通过多个转录组数据分析发现,脂肪酸代谢相关通路基因在定型内胚层分化过程中发生明显改变。通过Seahorse等实验,团队确定了在定型内胚层分化过程中,脂肪酸氧化水平升高,然而脂肪酸合成水平下降。通过小分子抑制剂和基因编辑技术,团队进一步确定抑制脂肪酸氧化会抑制定型内胚层分化,而抑制脂肪酸合成则可以促进定型内胚层分化,说明了定型内胚层分化依赖于脂肪酸氧化活性的上升和脂肪酸合成活性的下降。
其次,团队发现代谢物乙酰辅酶A(既是脂肪酸氧化途径的产物也是脂肪酸合成通路的底物)的水平在定型内胚层细胞中明显上升,并且通过提高乙酰辅酶A的水平能够回补脂肪酸氧化通路关键酶CPT2敲除的胚胎干细胞向定型内胚层分化受阻的表型以及由脂肪酸氧化通路抑制剂所导致的内胚层分化缺陷。机制上,乙酰辅酶A的上升导致了内胚层发育关键转录因子SMAD3的19位赖氨酸残基的乙酰化,从而促进了SMAD3的入核。
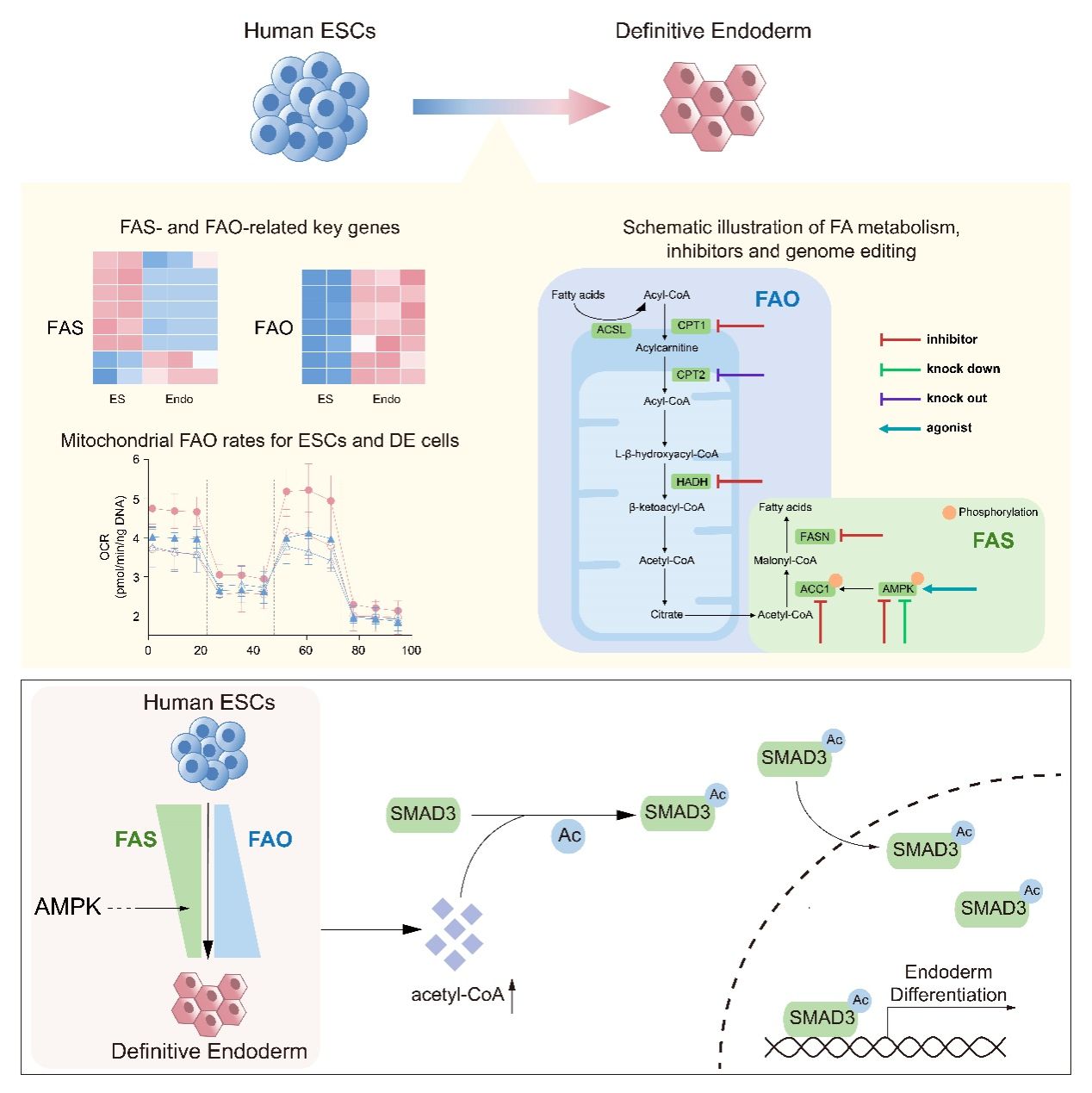
降低的脂肪酸合成和增强的脂肪酸氧化通过乙酰辅酶A来调控转录因子SMAD3的乙酰化进而促进内胚层分化
该研究阐明了脂肪酸氧化和脂肪酸合成代谢通路在定型内胚层分化过程中的变化,并探索了脂肪酸代谢对于定型内胚层分化调控的作用机制。该研究结果结合该课题组之前的关于线粒体稳态及能量代谢的研究报道(Redox Biol50:102248;Cell Death Discov8(1):69)共同揭示了细胞代谢对于人胚胎干细胞谱系特化的重要作用。
据悉,蒋卫课题组长期从事干细胞命运决定的分子调控机制和转化研究。近年来主要利用人多能干细胞维持和分化体系,聚焦于早期胚层分化的表观和代谢调控机制。主要研究成果包括:阐明长非编码RNA和内源性逆转录病毒原件在人多能性调控以及胚层分化中的作用及机制(Genome Biol2023;Nucleic Acids Res2022;Stem Cell Rep2020);揭示多个表观遗传因子调控早期胚层分化的机制(NatCommun2022;Development2023;Cell Death Dis2021);解析脂肪酸代谢及线粒体稳态调控细胞干性和分化的机制(Dev Cell2023;Redox Biol2022;Cell DeathDiscov2022)。同时,课题组在人新型多能干细胞及干细胞相关转化应用方面也做了一些探索性工作(Stem Cell Rep2021;CellDiscov2022;Theranostics2022;多项发明专利)。
本工作得到了国家自然科学基金、湖北省自然科学基金、中央高校基本科研业务费专项资金、武汉大学中外联合科研平台种子基金等项目的支持。医学研究院仪器设备共享中心为本研究提供了有力的硬件平台支持。
论文链接:https://www.cell.com/developmental-cell/fulltext/S1534-5807(23)00335-0
来源:武汉大学新闻网
(学生编辑:陈巧燕 编辑:肖珊)